Die Cholesterinbiosynthese
Oder: Wo kommt das Cholesterin eigentlich her?
Gesundheitsbewusste Zeitgenossen schauen vor dem Verzehr von Nahrungsmitteln gerne auf die handelsüblichen Nährwerttabellen der Nahrungsprodukte. Eins der ersten „Opfer“ der akribischen Suche ist die Menge an Cholesterin in den Produkten.
Denn: es geht das Märchen umher, dass ein Produkt gesünder ist, je weniger Cholesterin es enthält. Die Nahrungsmittelindustrie hat regelrechte Werbefeldzüge gestartet mit ihren Aussagen zu Cholesteringehalt und cholesterinarmen oder -freien Nahrungsmitteln. Damit hat jeder einen „Bösewicht“ im Auge, der von dem eigentlichen Bösewicht, dem Zucker, speziell Fruktose, ablenken hilft.
Wie hirnrissig diese „Cholesterinhysterie“ ist, wird klar, wenn wir uns vor Augen halten, dass das Cholesterin im Organismus nur zu 10 Prozent aus der Nahrung kommt. Der Rest von 90 Prozent wird vom Körper selbst hergestellt.
Ein Organismus, der seinen eigenen Bösewicht kreiert
Wenn man den Biosyntheseweg des Cholesterins betrachtet, dann fällt als erstes auf, dass die Natur einen eklatanten Aufwand betrieben hat, nur um sich seinen eigenen Bösewicht zu leisten. Das wiederum steht im ebenso eklatanten Widerspruch zu dem Wissen, dass die Natur in der Regel sehr ökonomisch mit ihren Ressourcen umgeht. Die Cholesterinbiosynthese – ein Beispiel dafür, wie die Natur sich selbst abschaffen will? Mit an Sicherheit grenzender Wahrscheinlichkeit ist das nicht der Fall.
Insgesamt werden fast 40 Reaktionsschritte benötigt, um Cholesterin zu synthetisieren. Zentrale Syntheseorte sind in erster Linie die Leber und die Darmschleimhäute.
Hier eine Übersicht über die Transportwege, wobei ich die Darmschleimhaut nicht erwähne:
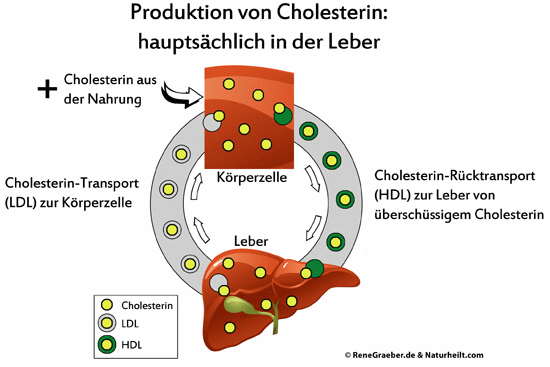
Da Cholesterin nicht in der Lage ist, die Blut-Hirn-Schranke zu passieren, synthetisiert das Gehirn sein benötigtes Cholesterin selbst. Die Schulmedizin gibt bei „zu hohen Cholesterinwerten“ Empfehlungen heraus, die auf eine cholesterinarme oder -freie Diät drängen und den Einsatz von Statinen vorsehen. Diese medikamentöse Maßnahme blockiert ein Enzym – die HMG-CoA-Reduktase, die an der Synthese des Cholesterins maßgeblich beteiligt ist.
Warum die Natur keine „Kosten und Mühen“ gescheut hat, diesen komplizierten Weg zu finden, wird verdeutlicht durch die Aufgaben und Funktionen, die Cholesterin ausüben muss. Es ist zentraler Bestandteil von Zellmembranen, eine Speichersubstanz (Reservestoff) und selbst Ausgangssubstanz für eine Reihe von anderen wichtigen Stoffen, ohne die ein Leben nicht denkbar ist (siehe Steroidhormone, Ubichinon-10 und Vitamin D).
Der gesamte Syntheseweg lässt sich in drei Grundschritte beziehungsweise Hauptabschnitte unterteilen:
- Die Bildung von HMG-CoA und Mevalonat und die Synthese des aktivierten Isoprens Isopentenyl-pyrophosphat.
- Der Zusammenschluss (Kondensation) von sechs Molekülen Isopentenyl-pyrophosphat zu Squalen.
- Zyklisierung (Aufbau von Ringstrukturen im Molekül) zu Lanosterin und dessen Umwandlung zu Cholesterin.
Vom Beginn der Biosynthese bis hin zum fertigen Cholesterin kommt es zu einer stetigen Zunahme der Zahl der Kohlenstoffatome in dem sich aufbauenden Molekül. Es beginnt mit 2 C-Atomen im Acetat (als Ausgangssubstanz), führt über Isoprenoid-Zwischenprodukt mit 5 C-Atomen, weiter zum Squalen mit 30 C-Atomen hin zum Cholesterin mit 27 C-Atomen. Auf dem Weg von Lanosterin zum Cholesterin gehen 3 C-Atome verloren durch die Bildung von Kohlendioxid. Mehr dazu habe ich auch im Beitrag „Cholesterin – chemischer Aufbau“ geschrieben.
Als Ausgangssubstanz dient Acetat beziehungsweise seine aktivierte Form als Essigsäure Acetyl-CoA. Durch die Verbindung dreier solcher Moleküle entsteht Hydroxy-Methylglutaryl-CoA. Letzteres wird im nächsten Syntheseschritt durch die eben erwähnte HMG-CoA-Reduktase zu Mevalonat reduziert. Setzt man an dieser Stelle die Statine ein, dann kommt es zum Stopp der Reaktion und kein Mevalonat kann mehr gebildet werden, was den weiteren Verlauf der Synthese unterbindet.
Die Bildung von Mevalonat wird als eine Schrittmacherreaktion angesehen, die die Synthesegeschwindigkeit des Cholesterins bestimmt und außerdem nicht reversibel ist. Das heißt, dass einmal gebildetes Mevalonat nicht mehr zurückgeführt werden kann zu HMG-CoA.
Weiter geht es mit einer dreimaligen Phosphorylierung des Mevalonats zu 3-Phospho-5-pyrophosphomevalonat und einer anschließenden Decarboxylierung (Entfernung von Kohlenstoff und Sauerstoff meist als Kohlendioxid), was zu Dimethylallyl-pyrophosphat führt.
Danach erfolgt eine dreifache Phosphorylierung, die über die Zwischensubstanzen Geranylpyrophosphat, Farnesyl-pyrophosphat zu Praesqualenpyrophosphat führt und dann im nächsten Schritt zur Bildung von Squalen. Bislang hatten alle Moleküle eine kettenartige Form. Aber ab diesem Punkt liegt das Hauptaugenmerk der Synthese auf der Ringbildung der gewonnenen Zwischensubstanzen.
Durch die Enzyme Squalen-Monooxygenase und Lanosterol-Synthase kommt es zur Synthese von Lanosterin. Von hier aus kommen noch einmal fast 20 Reaktionsschritte zum Einsatz, um über Zymosterol, Lathosterin und 7-Dehydrocholesterol zum Cholesterin zu gelangen.
Nach der Lanosterin-Produktion kommt es bei der Cholesterinbiosynthese zu zwei sich teilweise überschneidende Synthesewege. Beide Stoffwechselvorgänge unterscheiden sich dadurch, auf welcher Synthesestufe die Doppelbindung des Lanosterins am C-24 Atom reduziert wird. Welche biologische Bedeutung die verschiedenen Stoffwechselwege letztendlich haben, das können die Wissenschaftler heute noch nicht beschreiben. Sie vermuten hier gewebespezifische Unterschiede.
Diese beiden unterschiedlichen Stoffwechselwege werden Bloch-Weg und Kandutsch-Russel-Weg genannt. Charakteristisch für den Bloch-Weg ist, dass die Doppelbindung am C-24 Atom bis zum letzten Schritt der Reaktionskette aufrechterhalten wird. Die eigentliche Cholesterinbiosynthese erfolgt hier hauptsächlich über Desmosterin, das über eine Hydrierung zu Cholesterin synthetisiert wird. Das dazu notwendige Enzym ist die Sterol-Delta24-Reduktase.
Der Kandutsch-Russel-Weg zeichnet sich dadurch aus, dass eine sehr frühe Reduktion dieser Doppelbindung erfolgt, die hauptsächlich zur Produktion von Lathosterin und 7-Dehydrocholesterin führt. Durch das Enzym Lathosterol-5-Desaturase (Lathosterol-Oxidase) erfolgt die Synthese von 7-Dehydrocholesterin, das wiederum durch die 7-Dehydrocholesterol-Reduktase zu Cholesterin hydriert wird.
Merkwürdiges und Bemerkenswertes zur Cholesterinbiosynthese:
- Alle Kohlenstoffatome des fertigen Endprodukts Cholesterin stammen aus Acetyl-CoA-Molekülen.
- Neben Acetyl-CoA werden noch NADPH, ATP und O2 benötigt. Sie sind sozusagen der Brennstoff, der den Synthesevorgang vorantreibt.
- Die wichtigsten Schritte in dieser langen Kette sind:
✔ die Synthese von HMG-CoA und Mevalonat, die die Funktion der Schrittmacherreaktion haben. Von ihrer Bildung hängt die gesamte Synthesegeschwindigkeit der Cholesterinbiosynthese ab. die Synthese des aktivierten Isoprenoids (Isopentenyl-pyrophosphat).
✔ die Kondensation von sechs Isoprenoid-Molekülen zu Squalen.
✔ die Zyklisierung von Squalen mit der Bildung von Lanosterin.
✔ die Umwandlung von Lanosterin zu Cholesterin. - Die Existenz zweier verschiedener Synthesewege, die Bloch und Kandutsch und Russel beschrieben hatten und daher nach ihnen benannt sind.
Die Bilanz der Cholesterinbiosynthese sieht so aus – es werden für die Synthese benötigt (man nehme):
- 18 Moleküle Acetyl-CoA
- 18 Moleküle ATP
- 16 Moleküle NADPH und
- 4 Molekül O2
Als Ergebnis erhalten wir:
- Cholesterin
- 9 Moleküle CO2
- 16 Moleküle NADP+
- 18 Moleküle ADP und
- 18 Moleküle Pi (Phosphatgruppen)
Die Bioregulation der Cholesterinbiosynthese und der Aufnahme durch Nahrungsmittel wird über eine Reihe von Regulationsmechanismen vollzogen.
Die von den Statinen gehemmte HMG-CoA-Reduktase wird über natürliche Mechanismen von Cholesterin selbst und noch stärker durch sein Zwischenprodukt, dem Lanosterin, gehemmt. Oder mit anderen Worten: unter natürlichen Bedingungen hemmen erhöhte Cholesterin- und Lanosterin-Werte das zentrale Schrittmacher-Enzym, die HMG-CoA-Reduktase, so dass die Biosynthese zum Erliegen kommen muss. Je höher die Konzentrationen, desto ausgeprägter ist der Hemmeffekt. Dies ist ein typisches Beispiel eines negativen Feedback-Effekts zur Regulation biologischer und biochemischer Prozesse.
Lanosterin hat zudem eine „pharmakologische“ Wirkung auf die HMG-CoA-Reduktase: es verkürzt die Halbwertszeit des Enzyms, so dass ein schnellerer Abbau erfolgt, was die Biosyntheseaktivität nochmals abschwächt.
Darüber hinaus gibt es noch eine Reihe von indirekten Regulationsmechanismen, die im Wesentlichen auf die Konzentrationen von Cholesterin reagieren. Teilweise werden hier Gene ein- und ausgeschaltet, um die entsprechenden Effekte zu erreichen. Dieses Ein- und Ausschalten wird über spezifische Cholesterinrezeptoren gesteuert.
Übrigens: Wenn Sie solche Informationen interessieren, dann fordern Sie unbedingt meinen kostenlosen Praxis-Newsletter „Unabhängig. Natürlich. Klare Kante.“ dazu an:
Das Beitragsbild wurde mit KI erstellt.



Hinterlasse einen Kommentar
An der Diskussion beteiligen?Hinterlasse uns deinen Kommentar!